Zusammenfassung
Mit zunehmenden Interesse an der Überwachung eines breiteren Spektrums von PFAS in Trink- und Brauchwasser wird eine effiziente Methodik immer wichtiger. Hier haben wir einen einzigartigen Ansatz entwickelt, der die gleichzeitige Analyse ultrakurzkettiger PFAS zusammen mit alternativen und traditionellen PFAS ermöglicht, so dass C2, C3, C4, C6, C8 und alternative Verbindungen gemeinsam getestet werden können, ohne separate Methoden zu erfordern. Es werden Ergebnisse aus Validierungsversuchen vorgestellt.
Einführung
Ultrakurzkettige (C2 und C3) per- und polyfluorierte Alkylverbindungen (PFAS) sind kleine, hochpolare Verbindungen, deren Anteil am Gesamtgehalt aller PFAS in Umweltwasserproben (z. B. aus Regen, Flüssen und Grundwasser) mit mindestens 40 % angegeben wurde [1, 2, 3]. Zu den ultrakurzkettigen PFAS gehören Trifluoressigsäure (TFA), Perfluorpropansäure (PFPrA), Perfluorethansulfonat (PFEtS) und Perfluorpropansulfonat (PFPrS), wobei TFA am häufigsten vorkommt, aber mithilfe von chromatografischen Methoden schwierig zu analysieren ist. Aufgrund ihrer mangelnden Retention auf typischen Reversed-Phase (RP)-Säulen werden diese neuen ultrakurzkettigen Verbindungen in den aktuellen Verfahren für die PFAS-Überwachung jedoch nicht berücksichtigt. Andererseits zeigen auf Anionenaustausch-Chromatografie basierende Methoden oft zu viel Retention und eine schlechte chromatografische Performance für ultrakurzkettige PFAS. Noch größer wird die Herausforderung, wenn die gleichzeitige Überwachung ultrakurzkettiger, alternativer und traditioneller PFAS mithilfe einer einzigen Methode durchgeführt werden soll.
Zur Überwindung dieser Probleme benutzten wir eine spezielle Hybrid-HILIC/Ionenaustausch-Säule (Raptor Polar X) zur Entwicklung einer schnellen, einfachen LC-MS/MS-Methode für die umfassende Analyse von C2, C3, C4, C6, C8 und alternativen PFAS. Aufgrund des ausgewogenen Multimode-Retentionsverhaltens der Säule können ultrakurzkettige und langkettige PFAS gemeinsam in einem einzelnen isokratischen Lauf analysiert werden. Diese direkte Injektionsmethode wurde im Hinblick auf Genauigkeit und Richtigkeit bei angereicherten Wasserproben, darunter Leitungswasser, Flusswasser, Grundwasser und Abwasser aus einer öffentlichen Kläranlage, ausgewertet. Wie hier gezeigt, bietet diese Methode Wasserprüflaboratorien, die ihren vorhandenen PFAS-Assay um ultrakurzkettige Verbindungen erweitern möchten, ein einfaches Setup sowie einen hohen Probendurchsatz.
Experimenteller Teil
Chromatografische Methode:
Die chromatografischen Bedingungen waren wie folgt. Die Übergänge und der für jeden Analyten verwendete interne Standard sind in Tabelle I angegeben.
| Säule: | Raptor Polar X (2.7 µm, 50 mm x 2.1 mm ID [Art.-Nr. 9311A52]) | |
| Säulentemperatur: | 40 °C | |
| Injektionsvolumen: | 10 µL | |
| Mobile Phase A: | Water, 10 mM ammonium formate, 0.05% Ameisensäure | |
| Mobile Phase B: | Acetonitril:Methanol (60:40), 0.05% Ameisensäure | |
| Zeit (min) | %B | |
| 0.00 | 85 | |
| 8.00 | 85 | |
| Flussrate: | 0.5 mL/min | |
| Ionisationsmodus: | ESI- | |
| Messmodus: | MRM | |
Tabelle I: Analyt-MS-Übergänge für die gleichzeitige Analyse ultrakurzkettiger PFAS mit alternativen und traditionellen PFAS in Wasserproben.
| Analyt | Precursor-Ion | Produkt-Ion | Interner Standard zur Quantifizierung |
|---|---|---|---|
| TFA | 113.03 | 69.01 | 13C2-PFHxA |
| PFPrA | 163.03 | 119.01 | 13C2-PFHxA |
| PFBA | 212.97 | 168.97 | 13C2-PFHxA |
| PFHxA | 312.97 | 268.90 | 13C2-PFHxA |
| PFOA | 412.90 | 368.91 | 13C2-PFOA |
| HFPO-DA | 284.97 | 168.92 | 13C2-PFOA |
| ADONA | 376.90 | 250.93 | 13C2-PFOA |
| PFEtS | 198.98 | 79.92 | 13C3-PFBS |
| PFPrS | 248.97 | 79.98 | 13C3-PFBS |
| PFBS | 298.97 | 79.97 | 13C3-PFBS |
| PFHxS | 398.90 | 79.97 | 13C3-PFBS |
| PFOS | 498.84 | 79.97 | 13C4-PFOS |
| 9Cl-PF3ONS | 530.78 | 350.85 | 13C4-PFOS |
| 11Cl-PF3OUdS | 630.78 | 450.80 | 13C4-PFOS |
| 13C2-PFHxA | 314.97 | 269.93 | – |
| 13C2-PFOA | 414.90 | 369.87 | – |
| 13C3-PFBS | 301.90 | 79.97 | – |
| 13C4-PFOS | 502.84 | 79.97 | – |
Probenvorbereitung
In einem Polypropylenfläschchen (zur Verminderung der Hintergrundkontamination) wurden 250 µL der einzelnen Wasserproben mit 250 µL Methanol und 5 µL interner Standardlösung (10 ng/mL of 13C2-PFHxA, 13C2-PFOA, 13C3-PFBS, 13C4-PFOS in Methanol) vermischt. Das Fläschchen wurde zur Injektion und Analyse mit einem Polyethylendeckel (ebenfalls zur Verminderung der Hintergrundkontamination) verschlossen.
Kalibrierstandards wurden unter Verwendung von deionisiertem Wasser (erzeugt mithilfe eines Thermo Scientific Barnstead E-Pure-Systems) hergestellt und mit 14 Analyten in Konzentrationen von 10–800 ng/L angereichert. Die Kalibrierstandardlösungen wurden dann 1:1 in Methanol verdünnt wie oben im Schritt Probenvorbereitung beschrieben.
Eine Leitungswasserprobe aus der Restek-Anlage und drei von der US-Umweltbehörde EPA zur Verfügung gestellte Wasserproben (Wasser aus dem Chicago River, Grundwasser und Abwasser aus einer öffentlichen Kläranlage) wurden mit 40 und 160 ppt angereichert. Nichtangereicherte und angereicherte Proben wurden zur chromatografischen Analyse wie oben 1:1 in Methanol verdünnt und mit den Kalibrierstandards quantifiziert. Für TFA-Messungen im Grundwasser wurde die Probe wegen der hohen TFA-Konzentration vor der Anreicherung mit 40 und 160 ppt mit deionisiertem Wasser fünffach verdünnt.
Ergebnisse und Diskussion
Chromatografische Performance
Es wurde eine isokratische Elution entwickelt, die eine schnelle, einfache Analyse ultrakurzkettiger PFAS gemeinsam mit alternativen und traditionellen PFAS in Wasserproben ermöglichte. Alle Analyten eluierten in 4 Minuten mit ausgewogener Retention und guten Peakformen (Abbildung 1). Bei keiner der Wasserproben wurden bei Verwendung einer Zykluszeit von 8 Minuten Matrixeffekte beobachtet. Wie weiter unten besprochen, hat sich die ca. 4-minütige Haltezeit nach der letzten eluierenden Verbindung als notwendig erwiesen, um potenzielle Matrixeffekte zu vermeiden.
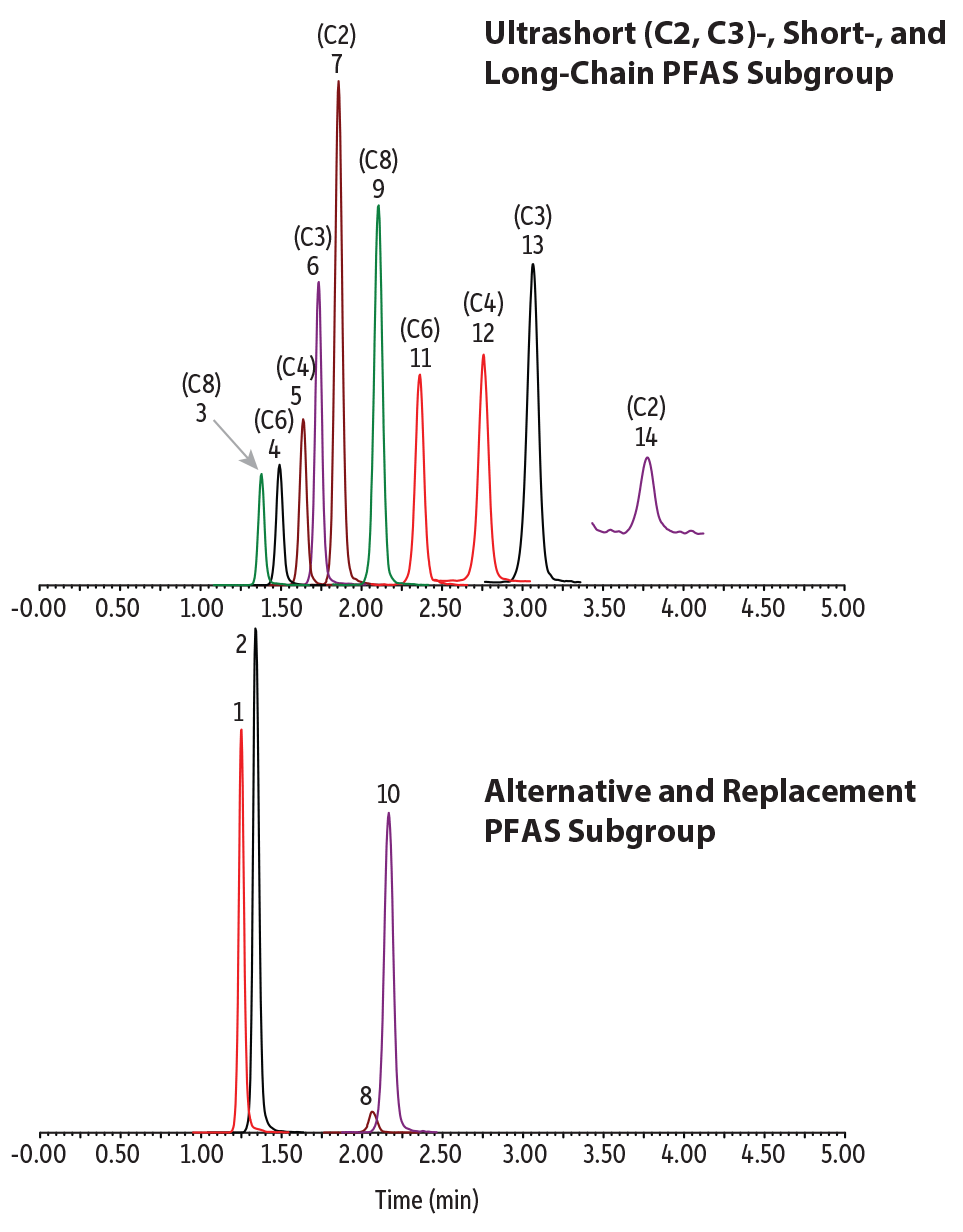
LC_EV0569
Peaks
| Peaks | tR (min) | Conc. (ng/L) | Precursor Ion | Product Ion | |
|---|---|---|---|---|---|
| 1. | 11-Chloroeicosafluoro-3-oxanonane-1-sulfonate (11CL-PF3OUdS) | 1.25 | 400 | 630.78 | 450.80 |
| 2. | 9-Chlorohexadecafluoro-3-oxanonane-1-sulfonate (9Cl-PF3ONS) | 1.34 | 400 | 530.78 | 350.85 |
| 3. | Perfluorooctanesulfonic acid (PFOS) | 1.38 | 400 | 498.84 | 79.97 |
| 4. | Perfluorohexanesulfonic acid (PFHxS) | 1.49 | 400 | 398.90 | 79.97 |
| 5. | Perfluorobutanesulfonic acid (PFBS) | 1.64 | 400 | 298.97 | 79.97 |
| 6. | Perfluoropropanesulfonic acid (PFPrS) | 1.73 | 400 | 248.97 | 79.98 |
| 7. | Perfluoroethanesulfonic acid (PFEtS) | 1.86 | 400 | 198.98 | 79.92 |
| Peaks | tR (min) | Conc. (ng/L) | Precursor Ion | Product Ion | |
|---|---|---|---|---|---|
| 8. | Hexafluoropropylene oxide dimer acid (HFPO-DA) | 2.06 | 400 | 284.97 | 168.92 |
| 9. | Perfluorooctanoic acid (PFOA) | 2.11 | 400 | 412.90 | 368.91 |
| 10. | Ammonium 4,8-dioxa-3H-perfluorononanoate (ADONA) | 2.15 | 400 | 376.90 | 250.93 |
| 11. | Perfluorohexanoic acid (PFHxA) | 2.36 | 400 | 312.97 | 268.90 |
| 12. | Perfluorobutanoic acid (PFBA) | 2.76 | 400 | 212.97 | 168.97 |
| 13. | Perfluoropropionic acid (PFPrA) | 3.06 | 400 | 163.03 | 119.01 |
| 14. | Trifluoroacetic acid (TFA) | 3.77 | 400 | 113.03 | 69.01 |
Conditions
| Column | Raptor Polar X (cat.# 9311A52) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 50 mm x 2.1 mm ID | ||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||
| Temp.: | 40 °C | ||||||||||||
| Standard/Sample | |||||||||||||
| Diluent: | 50:50 Water:methanol | ||||||||||||
| Conc.: | 400 ng/L | ||||||||||||
| Inj. Vol.: | 10 µL | ||||||||||||
| Mobile Phase | |||||||||||||
| A: | Water, 10 mM ammonium formate, 0.05% formic acid | ||||||||||||
| B: | 60:40 Acetonitrile:methanol, 0.05% formic acid | ||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
Linearität
Der Kalibrierbereich ist 20–800 ppt für TFA und 10–800 ppt für alle anderen Analyten. Vier interne Standards wurden ausgewertet, um die am besten angepasste Standardkurve für die verschiedenen Analyten zu bestimmen. Alle Verbindungen zeigten akzeptable Linearität mit r2 Werten >0.996 und Abweichungen <20% bei Verwendung einer quadratischen Regression (gewichtet 1/x).
Richtigkeit und Genauigkeit
In unseren anfänglichen Versuchen wurden bei der Analyse von Wasserproben mit einem isokratischen Lauf von 5 Minuten Matrixeffekte für das TFA-Signal beobachtet. Anschließend wurden unterschiedliche Analysezeiten getestet, und es wurde bestimmt, dass eine 8-minütige Laufzeit notwendig war, um Matrixeffekte für alle Analyten auszuschließen. Die isokratische Haltezeit muss möglicherweise abhängig von der spezifischen Geräteausstattung und/oder den zu analysierenden Proben modifiziert werden.
Die nichtangereicherten Wasserproben zeigten unterschiedliche Konzentrationen an TFA, C3, C4, C6 und C8 PFAS ohne nachweisbares ADONA, HFPO-DA, 9Cl-PF3ONS, und 11Cl-PF3OUdS (Tabelle II). Ein Beispielschromatogramm einer Analyse ultrakurzkettiger PFAS mit gleichzeitiger Bestimmung von alternativen und traditionellen PFAS in einer nichtangereicherten Abwasserprobe aus einer öffentlichen Kläranlage ist in Abbildung 2 gezeigt.
Tabelle II: Nachweisbare Analyten in nichtangereicherten Wasserproben.
| Nachgewiesene Konzentration (ng/L) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Proben | TFA | PFPrA | PFBA | PFHxA | PFOA | HFPO-DA | ADONA | PFEtS | PFPrS | PFBS | PFHxS | PFOS | 9Cl-PF3ONS | 11Cl-PF3OUdS |
| Leitungswasser | 164.2 | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND |
| Flusswasser | 193.3 | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND | ND |
| Grundwasser | 1425 | ND | ND | ND | 5.4 | ND | ND | ND | ND | 6.7 | 3.9 | ND | ND | ND |
| Abwasser aus öffentlicher Kläranlage | 352.8 | 9.6 | 15.3 | 93.5 | 20.4 | ND | ND | ND | ND | 6.8 | 6.7 | 9.6 | ND | ND |
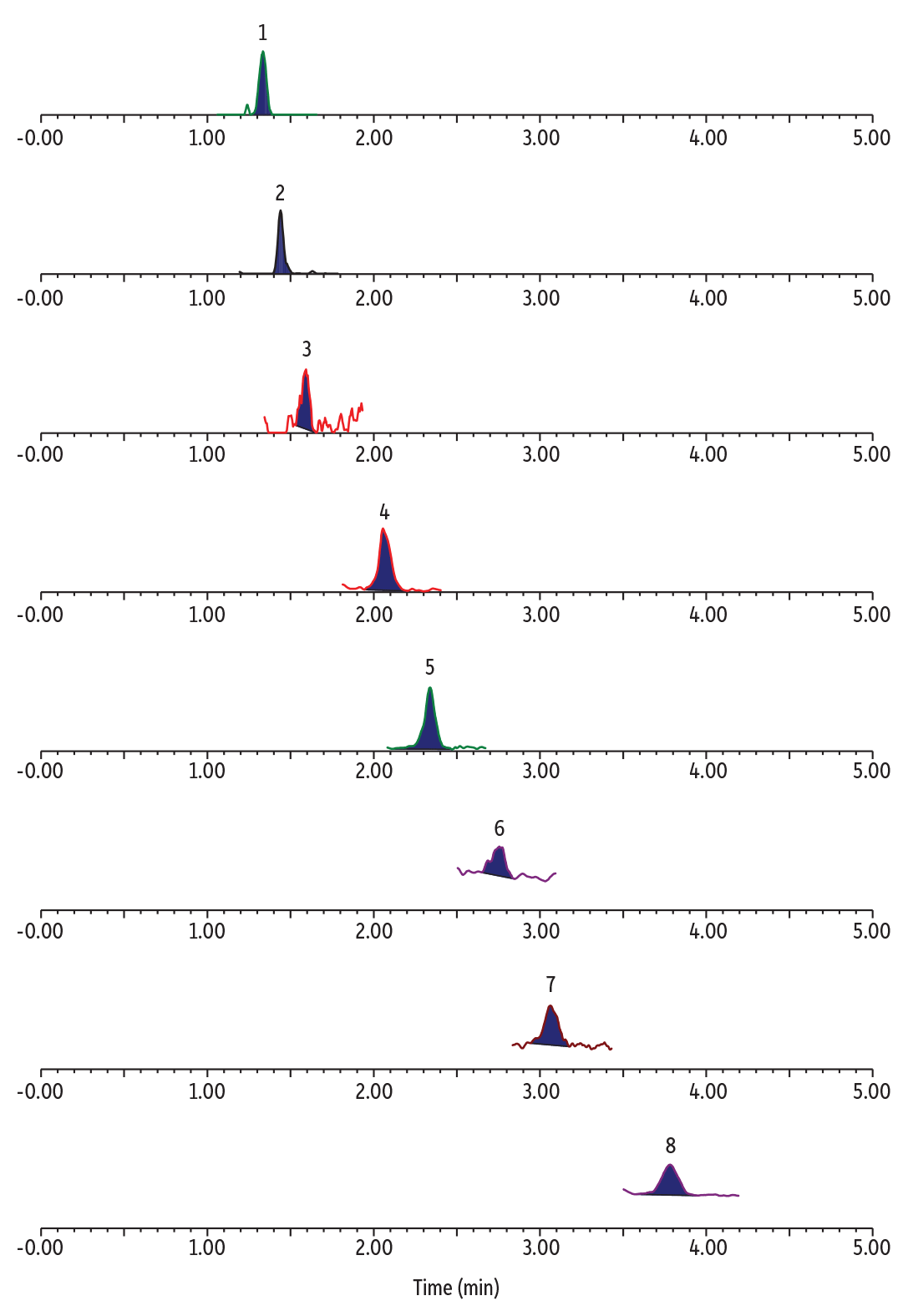
LC_EV0572
Peaks
| Peaks | tR (min) | Precursor Ion | Product Ion | |
|---|---|---|---|---|
| 1. | Perfluorooctanesulfonic acid (PFOS) | 1.35 | 498.84 | 79.97 |
| 2. | Perfluorohexanesulfonic acid (PFHxS) | 1.45 | 398.90 | 79.97 |
| 3. | Perfluorobutanesulfonic acid (PFBS) | 1.58 | 298.97 | 79.97 |
| 4. | Perfluorooctanoic acid (PFOA) | 2.05 | 412.90 | 368.91 |
| 5. | Perfluorohexanoic acid (PFHxA) | 2.34 | 312.97 | 268.90 |
| 6. | Perfluorobutanoic acid (PFBA) | 2.76 | 212.97 | 168.97 |
| 7. | Perfluoropropionic acid (PFPrA) | 3.06 | 163.03 | 119.01 |
| 8. | Trifluoroacetic acid (TFA) | 3.78 | 113.03 | 69.01 |
Conditions
| Column | Raptor Polar X (cat.# 9311A52) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 50 mm x 2.1 mm ID | ||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||
| Temp.: | 40 °C | ||||||||||||
| Standard/Sample | |||||||||||||
| Diluent: | Methanol | ||||||||||||
| Conc.: | Endogenous levels | ||||||||||||
| Inj. Vol.: | 10 µL | ||||||||||||
| Mobile Phase | |||||||||||||
| A: | Water, 10 mM ammonium formate, 0.05% formic acid | ||||||||||||
| B: | Acetonitrile:methanol (60:40), 0.05% formic acid | ||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
| Sample Preparation | In a polypropylene vial, 250 μL of blank POTW water was mixed with 250 μL of methanol and 5 μL of internal standard solution (10 ng/mL of 13C2-PFHxA, 13C2-PFOA, 13C3-PFBS, and 13C4-PFOS in methanol). The vial was capped with a polyethylene cap for injection analysis. |
Zur Bestimmung der Richtigkeit (prozentuale Wiederfindung) wurden die gemessenen Mengen der Analyten in den angereicherten Proben unter Zuhilfenahme der Konzentrationen in den nichtangereicherten Proben korrigiert. Wasserproben wurden für jede analytische Charge in zweifacher Ausführung mit niedrigen und hohen Konzentrationen angereichert. Insgesamt wurden drei analytische Chargen an verschiedenen Tagen gemessen. Tabelle III zeigt die Ergebnisse für Richtigkeit und Genauigkeit, berechnet aus den gesammelten Daten für die drei Chargen. Die Verfahrensgenauigkeit wurde durch Wiederfindungswerte innerhalb von 30 % der nominellen Konzentration bei beiden Konzentrationen der angereicherten Proben und durch die LLOQ-Konzentrationen in den Wasserproben belegt. Die relative Standardabweichung %RSD war kleiner als 25 %, was auf eine akzeptable Genauigkeit der Methode für die Analyse ultrakurzkettiger PFAS gleichzeitig mit alternativen und traditionellen Verbindungen in Wasser hindeutet.
Tabelle III: Richtigkeit und Genauigkeit der Methode
| Average %Accuracy (%RSD) | |||||||||
| Matrices | Leitungswasser | Flusswasser | Grundwasser** | Abwasser aus öffentlicher Kläranlage | Abwasser aus öffentlicher Kläranlage | ||||
| Konzentration (ng/L) | 40 | 160 | 40 | 160 | 40 | 160 | 40 | 160 | 10* (LLOQ) |
| TFA | 106 (16.9) | 97.9 (7.10) | 97.4 (10.8) | 97.6 (6.12) | 97.5 (14.5) | 103 (8.87) | 102 (17.1) | 96.4 (7.33) | 107 (3.55) |
| PFPrA | 95.1 (4.08) | 105 (3.48) | 94.5 (6.85) | 104 (2.36) | 103 (9.37) | 105 (8.34) | 91.8 (4.90) | 104 (7.09) | 109 (1.61) |
| PFBA | 106 (6.80) | 117 (3.18) | 105 (7.40) | 114 (4.91) | 111 (2.48) | 120 (3.27) | 106 (6.58) | 114 (4.85) | 104 (4.91) |
| PFHxA | 93.3 (7.41) | 111 (2.61) | 91.8 (11.34) | 103 (4.55) | 102 (6.62) | 109 (7.11) | 103 (8.37) | 108 (3.13) | 115 (1.64) |
| PFOA | 100 (4.24) | 107 (3.14) | 103 (6.71) | 105 (2.64) | 92.6 (3.85) | 107 (3.09) | 102 (4.57) | 109 (3.64) | 106 (3.28) |
| HFPO-DA | 95.7 (11.9) | 108 (9.05) | 86.6 (8.97) | 104 (5.45) | 94.1 (18.6) | 105 (9.35) | 95.2 (8.49) | 106 (9.23) | 102 (16.8) |
| ADONA | 106 (3.75) | 116 (2.38) | 100 (6.86) | 110 (4.59) | 104 (4.91) | 113 (5.23) | 111 (5.26) | 115 (2.65) | 105 (4.76) |
| PFEtS | 94.8 (9.68) | 110 (5.39) | 89.4 (7.43) | 102 (9.76) | 96.5 (4.09) | 108 (6.11) | 104 (8.18) | 109 (5.23) | 99.8 (9.85) |
| PFPrS | 104 (4.97) | 115 (4.19) | 95.0 (3.87) | 107 (4.26) | 106 (10.6) | 114 (3.36) | 111 (4.88) | 114 (2.96) | 108 (3.28) |
| PFBS | 97.4 (10.1) | 113 (3.97) | 93.6 (5.24) | 104 (4.19) | 97.8 (4.47) | 107 (4.23) | 94.1 (10.7) | 108 (4.48) | 100 (11.0) |
| PFHxS | 99.4 (15.7) | 114 (3.56) | 94.3 (9.79) | 104 (5.28) | 95.2 (5.63) | 112 (3.20) | 104 (8.19) | 111 (4.07) | 107 (11.7) |
| PFOS | 104 (7.54) | 107 (7.69) | 103 (8.43) | 105 (7.23) | 97.3 (14.9) | 110 (4.84) | 109 (7.47) | 108 (7.53) | 102 (4.20) |
| 9Cl-PF3ONS | 98.7 (3.52) | 105 (8.35) | 91.8 (7.66) | 103 (5.68) | 94.7 (9.83) | 105 (8.90) | 105 (6.76) | 107 (8.27) | 107 (4.31) |
| 11Cl-PF3OUdS | 106 (10.1) | 113 (3.54) | 95.0 (3.52) | 113 (8.15) | 107 (6.61) | 112 (4.54) | 119 (4.25) | 120 (9.10) | 98.2 (11.3) |
*20 ng/L LLOQ für TFA
**Grundwasser wurde nur für TFA fünffach verdünnt
Schlussfolgerung
Für die Analyse ultrakurzkettiger PFAS gemeinsam mit alternativen und traditionellen PFAS in Wasserproben wurde eine vereinfachte isokratische Methode entwickelt und validiert. Aufgrund der ausgewogenen, Multimode-Retention dieser Analyten auf einer Raptor Polar X-Säule (2.7 µm, 50 mm x 2.1 mm) erwies sich diese Analysemethode als schnell, robust und empfindlich und zeigte akzeptable Richtigkeit und Genauigkeit. Die Methode ist gut geeignet für Analytiklabore, die ihre vorhandenen PFAS-Assays für Trink- und Brauchwasser auf die Analyse von C2- und C3-Verbindungen erweitern möchten.
Literatur
- S. Taniyasu, K. Kannan, L.W.Y. Yeung, K.Y. Kwok, P.K.S Lam, N. Yamashita, Analysis of trifluoroacetic acid and other short-chain perfluorinated acids (C2-C4) in precipitation by liquid chromatography-tandem mass spectrometry: comparison to patterns of long-chain perfluorinated acids (C5-C18), Anal. Chim. Acta. 619 (2008) 221-230. https://pubmed.ncbi.nlm.nih.gov/18558116/
- J. Janda, K. Nodler, H-J. Brauch, C. Zwiener, F.T. Lange, Robust trace analysis of polar (C2-C8) perfluorinated carboxylic acids by liquid chromatography-tandem mass spectrometry: method development and application to surface water, groundwater, and drinking water, Environ. Sci. Pollut.R. 26 (2018) 7326-7336. https://pubmed.ncbi.nlm.nih.gov/29557039/
- K.Y. Kwok, S. Taniyasu, L.W.Y. Yeung, M.B. Murphy, P.K.S. Lam, Y. Horii, K. Kannan, G. Petrick, R.K. Sinha, N. Yamashita, Flux of perfluorinated chemicals through wet deposition in Japan, the United States, and other countries, Environ. Sci. Technol. 44 (2010) 7043-7049. https://pubmed.ncbi.nlm.nih.gov/20795671/



